Este es un ejemplo de Evaporación. Las moléculas del gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Al querer salir por el mínimo orificio que tiene la Pava silbadora, esta va a provocar su Silbido.
Fisicanuncia
viernes, 26 de noviembre de 2010
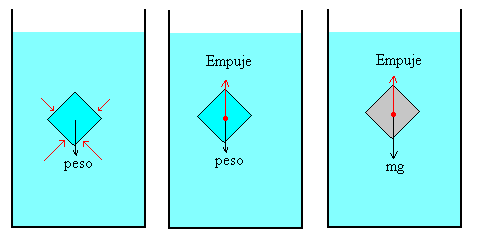
PRINCIPIO DE ARQUIMEDES
La explicación del principio de Arquímedes consta de dos partes como se indica en la figuras:
- El estudio de las fuerzas sobre una porción de fluido en equilibrio con el resto del fluido.
- La sustitución de dicha porción de fluido por un cuerpo sólido de la misma forma y dimensiones.
 |
| Globo aerostático construido por Débora Muraro, Agostina Roldan, Solange Chaparro y Canela Martinez. |
CAMBIOS DE ESTADO
Los tres estados de agregación de la materia son e estado sólido, líquido y Gaseoso.
Si se incrementa la temperatura el sólido va descomponiéndose hasta desaparecer la estructura cristalina, alcanzando el estado líquido. Tiene una capacidad de fluir y adaptarse a la forma del recipiente que lo contiene. En este caso, aún existe cierta unión entre los átomos del cuerpo, aunque mucho menos intensa que en los sólidos. Las principales características son: Cohesión menor, Movimiento energía cinética, No poseen forma definida, Toma la forma de la superficie o el recipiente que lo contiene, En el frío se comprime, excepto el agua, Volumen constante.
 Vaporización: pasaje de estado líquido a estado de vapor. Por ejemplo el agua líquida, cloroformo, éter.
Vaporización: pasaje de estado líquido a estado de vapor. Por ejemplo el agua líquida, cloroformo, éter.
Sólidos
A bajas temperaturas, los materiales se presentan como cuerpos de forma compacta y precisa; y sus átomos a menudo se entrelazan formando estructuras cristalinas definidas, lo que les confiere la capacidad de soportar fuerzas sin deformación aparente. Los sólidos son calificados generalmente como duros y resistentes, y en ellos las fuerzas de atracción son mayores que las de repulsión. La presencia de pequeños espacios intermoleculares caracteriza a los sólidos dando paso a la intervención de las fuerzas de enlace que ubican a las celdillas en una forma geométrica. Presentan varias características: Forma definida, Incompresibilidad, Resistencia a la fragmentación, Fluidez muy baja o nula.
Líquido
Si se incrementa la temperatura el sólido va descomponiéndose hasta desaparecer la estructura cristalina, alcanzando el estado líquido. Tiene una capacidad de fluir y adaptarse a la forma del recipiente que lo contiene. En este caso, aún existe cierta unión entre los átomos del cuerpo, aunque mucho menos intensa que en los sólidos. Las principales características son: Cohesión menor, Movimiento energía cinética, No poseen forma definida, Toma la forma de la superficie o el recipiente que lo contiene, En el frío se comprime, excepto el agua, Volumen constante.
Gaseoso
Incrementando aún más la temperatura se alcanza el estado gaseoso. Las moléculas del gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Presenta las siguientes características: cohesión casi nula, Sin forma definida, Su volumen es variable dependiendo del recipiente que lo contenga, Pueden comprimirse fácilmente, Ejercen presión sobre las paredes del recipiente contenedor, Las moléculas que lo componen se mueven con libertad.
Resumimos:
Estado de Agregación | Sólido | Líquido | Gas |
Volumen | Definido | Definido | Indefinido |
Forma | Definida | Indefinida | Indefinida |
Compresibilidad | Incompresible | Incompresible | Compresible |
Atracción entre Moléculas | Intensa | Moderada | Despreciable |
Cambios de Estado de la Materia
Los cambios de estado son cambios físicos ya que cambia el estado físico de la sustancia. Mientras dura el cambio de estado la temperatura permanece constante.
| Sólido | ® | Fusión | ® | Liquido |
| ¬ | Solidificación | ¬ | ||
| Sólido | ® | Volatilización | ® | Gas |
| ¬ | Sublimación | ¬ | ||
| Sólido | ® | Volatilización | ® | Vapor |
| ¬ | Sublimación | ¬ | ||
| Liquido | ® | Gasificación | ® | Gas |
| ¬ | Licuación | ¬ | ||
| Liquido | ® | Vaporización | ® | Vapor |
| ¬ | Condensación | ¬ | ||
Entonces...
Fusión: pasaje de estado sólido a estado líquido. Por ejemplo el hielo (agua sólida).
Solidificación: pasaje de estado líquido a estado sólido.
 Vaporización: pasaje de estado líquido a estado de vapor. Por ejemplo el agua líquida, cloroformo, éter.
Vaporización: pasaje de estado líquido a estado de vapor. Por ejemplo el agua líquida, cloroformo, éter.Condensación: pasaje de estado de vapor a estado líquido.
Gasificación: pasaje de estado líquido a estado gaseoso. Por ejemplo el metano líquido.
Licuación: pasaje de estado gaseoso a estado líquido.
Volatilización: pasaje de estado sólido a estado vapor. Por ejemplo el dióxido de carbono sólido (CO2) o hielo seco, la naftalina y el iodo.
Sublimación: pasaje de estado vapor a estado sólido.
VIDEO DE EQUILIBRIO TÉRMICO Y TIPOS DE TRANSMISIÓN DEL CALOR
Este es un video que encontramos que explica muy bien el Equilibrio térmico y los tipos de transmisión de calor, esperamos que les guste.
jueves, 25 de noviembre de 2010
TRANSMISIÓN DEL CALOR
TRANSMISIÓN DE CALOR POR CONVECCIÓN |
EL CALOR
El calor se define como el traspaso de energía de un cuerpo a otro con la variación de temperatura de ambos hasta llegar al equilibrio térmico. El calor solamente se pone de manifiesto cuando se transfiere del sistema a los alrededores o viceversa.
La cantidad de energía transmitida se lo llama Cantidad de Calor, representada por la siguiente formula:
Q= m.ce.(Tf -Ti) La Q es la cantidad de calor, representadas en calorías; la m es la masa, ce es el calor especifico del agua que es 1 y donde Tf es la temperatura final y Ti es la temperatura inicial.
¿Sabes lo que es la temperatura y el equilibrio térmico?
La temperatura es la sensación física que nos produce un cuerpo cuando entramos en contacto con él. Observamos cambios en los cuerpos cuando cambian su temperatura, por ejemplo, la dilatación que experimenta un cuerpo cuando incrementa su temperatura. Esta propiedad se usa para medir la temperatura de un sistema. Cuando dos cuerpos en cuyas condiciones iniciales tenian diferentes temperaturas se igualan, es decir, que sus temperaturas ahora estan igualadas se produce un Equilibrio térmico.
Formula del Equilibrio térmico:
Un cuerpo pierde calor (-Q) otro lo gana en igual medida (+Q).
(-Q) = (+Q)
m1.ce1.(Tf1 -Ti1)=m2.ce2.(Tf2-Ti2)
m1.ce1.(Ti1 -Te)=m2.ce2.(Te-Ti2)
La cantidad de energía transmitida se lo llama Cantidad de Calor, representada por la siguiente formula:
Q= m.ce.(Tf -Ti) La Q es la cantidad de calor, representadas en calorías; la m es la masa, ce es el calor especifico del agua que es 1 y donde Tf es la temperatura final y Ti es la temperatura inicial.
¿Sabes lo que es la temperatura y el equilibrio térmico?
La temperatura es la sensación física que nos produce un cuerpo cuando entramos en contacto con él. Observamos cambios en los cuerpos cuando cambian su temperatura, por ejemplo, la dilatación que experimenta un cuerpo cuando incrementa su temperatura. Esta propiedad se usa para medir la temperatura de un sistema. Cuando dos cuerpos en cuyas condiciones iniciales tenian diferentes temperaturas se igualan, es decir, que sus temperaturas ahora estan igualadas se produce un Equilibrio térmico.
Formula del Equilibrio térmico:
Un cuerpo pierde calor (-Q) otro lo gana en igual medida (+Q).
(-Q) = (+Q)
m1.ce1.(Tf1 -Ti1)=m2.ce2.(Tf2-Ti2)
m1.ce1.(Ti1 -Te)=m2.ce2.(Te-Ti2)
Suscribirse a:
Entradas (Atom)